Az előző cikkekben az véralvadás örökletes problémái közül arról esett szó, amikor az elvérzés veszélye a jelentette a fő fenyegetést. Nem szabad elfeledkezni azonban arról, hogy napjainkban nem is ez a fő veszélyforrás. A modern társadalmak krónikus betegségeihez, életmódjához, gyógyszereléséhez tartozó gond inkább a fokozott alvadással járó kórképek, melyek szintén halálosak lehetnek.
Mindenki hallott már a családjában vagy ismeretségi körében arról, hogy valakinek infarktusa volt, stroke-ot kapott, trombózisa lett, vérhígítót kell szednie stb. Ezek éppúgy potenciálisan életveszélyes kórképek, mint a vérzékenység, csak épp annál jóval gyakoribbak és aktuálisabbak.
Ezek között is szerepel azonban olyan, megbetegedés, melynek döntően genetikai alapja van. Itt szeretném hangsúlyozni, hogy az orvostudomány általában minden kórképhez rendel, vagy feltételez mögötte örökletes hajlamot, mely valamiképpen befolyásolja azok kialakulását, lefolyását és kezelhetőségét. Elég például csak arra gondolnunk, hogy vannak emberek (ugyan nem sok!), akik naponta elszívnak 2 doboz cigarettát akár 40 éven keresztül is, és mégsem alakul ki náluk tüdőrák. Ezzel szemben ott vannak egyes embertársaink, akik akár egész életükben még csak egy szál cigarettát sem szívtak el, és mégis tüdődaganatosak. Nyilván e mögött a jelenség mögött bizonyos fokig a genetikai háttér is szerepet játszik. De ez nem jelenti azt, hogy ez 100%-ban meg is véd minden bajtól, pl. a daganatoktól. Senki sem garantálja ugyanis azt, hogy a fenti szerencsésebb emberek nem szenvedhetnek-e majd asztmától vagy egyéb krónikus tüdőbetegségtől, magasvérnyomástól, stroke-tól, infarktustól, más daganatoktól stb. a későbbiek folyamán, melyek szintén a dohányzással függhetnek össze. Arról nem is beszélve, hogy a genetika védhet ugyan, de az esély akkor is többszörös a tüdőrákra cigarettázás mellett, és egy idő után a genetikai háttér már kevés lesz. Ugyanez érvényes lehet egyéb krónikus betegségekre pl.: szívbetegségek, agyi keringési zavarok, stroke, cukorbetegség, magasvérnyomás betegség, elhízás, daganatok stb. Ha valaki helytelenül éli az életét, nem egészségtudatosan, akkor bizony jó genetika ide vagy oda, előbb-utóbb súlyos árat fog fizetni, ami könnyen lehet, hogy az életébe is kerülhet.
A trombózisra, azaz vérrögképződésre való hajlam tekintetében is nyilván hordozunk valamiféle genetikai információt, hajlamot. Ez lehet kedvező vagy kedvezőtlen. Vannak azonban olyan esetek, amikor a genetikai hajlam erősebben érint e tekintetben egyes embereket, és még normál életmód mellett is sajnos nagyobb eséllyel kell fokozott vérrögképződéssel számolniuk. Ilyen például az ún. aktivált proteinC rezisztencia/APC/Leiden-mutáció (továbbiakban: APC vagy Leiden-mutáció), mely a hemofília A-hoz hasonlóan szintén egy mutáció eredménye, csak épp fokozott alvadékonysági hajlammal jár.
A Leiden-mutáció lényege:
Az előző blogokban és cikkekben viszonylag részletesen beszéltünk a véralvadási kaszkád kulcsfontosságáról, mely a vérzés megállításában létfontosságú vérrög- stabilizálásában játszik szerepet. E rendszer nélkül elvéreznénk: www.medukacio.hu/index.php/item/a-verzekenyseg-i. A linkkel kapcsolatos bejegyzésben a véralvadás folyamatát írtam le odáig, hogy a stabilitást megadó fibrinháló kialakul. Na de mi vet véget az alvadási kaszkád folyamatának? A kérdés nagyon fontos, ugyanis ha folyamat leállítása elmarad, akkor bizony a véralvadásnak nem lesz gátja, és fokozott vérrögképződéssel, fokozott trombózis hajlammal kell majd számolnunk, ami bizony életveszélyes (szívinfarktus, stroke- tüdőembólia stb.). A lenti ábrán látható, hogy a „trombin” kulcsszerepet játszik az alvadás erősítésében. Az ábrából kitűnik (hajlított nyilak), hogy ez a molekula miként segíti elő az alvadási faktorok aktívvá alakulását (a=aktív az ábrán). Fantasztikusan érdekes azonban az, hogy éppen ugyanez a molekula lesz majd az, aki mindezt el kezdi leállítani. De hogyan? Honnan „tudja” egy molekula, hogy mikor mit kell tenni? Amikor az ép érfal trombomodulin nevű molekulájához kötődik a trombin, akkor ez utóbbi olyan szerkezeti változásokon megy keresztül, ami miatt már nem az alvadást elősegítő faktorokat, hanem az ún. proteinC-t fogja aktiválni. Az aktivált proteinC pedig inaktiválni fogja mind az aktív VIII-as (VIIIa) mind az aktív V-ös (Va) alvadási faktort, így az alvadási folyamat el kezd lecsengeni.
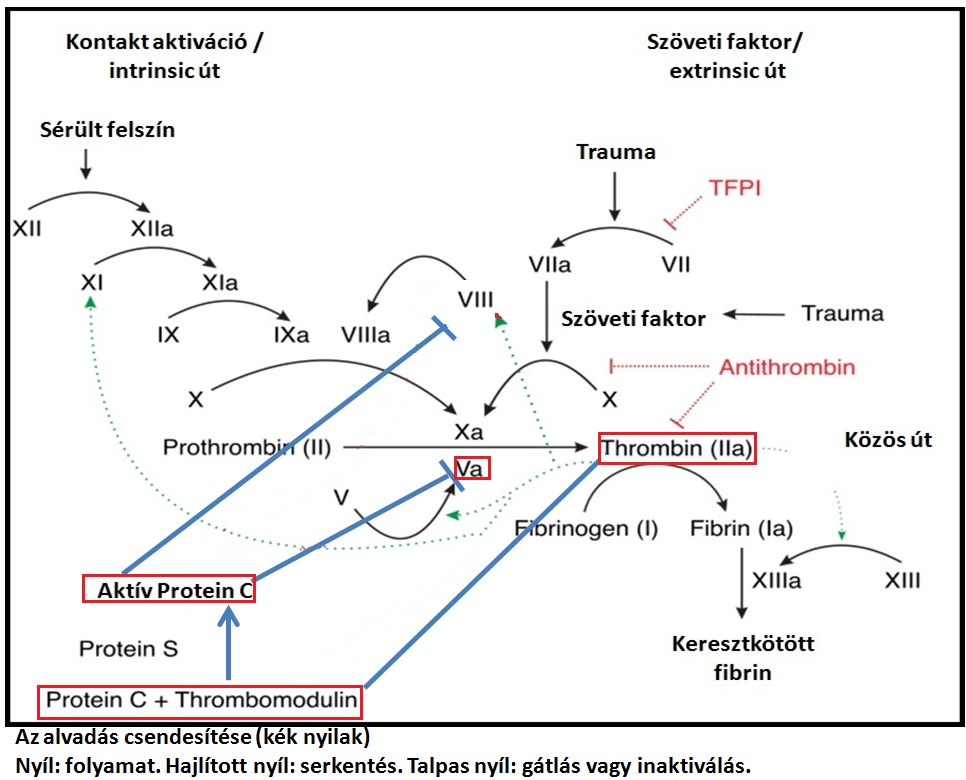
Az APC esetében azonban, az V-ös alvadási faktor génjének mutációja következtében az V-ös faktor szerkezetében olyan változások jönnek létre, ami miatt a proteinC sajnos csak nagyon lassan lesz képes az aktivált V-ös faktort (Va) inaktiválni. Ezért az alvadás nem fog kellő mértékben lassulni, így fokozott vérrögképződéssel, fokozott trombózis hajlammal kell számolni.
A betegség gyanújának felmerülése után a diagnózis felállításához a laboratóriumi vizsgálatok elengedhetetlenek. A szindróma előfordulásáról, részletesebb gyakorlati leírásáról, kockázatairól, kezeléséről, egyéb vonatkozásairól a www.medukacio.hu -n lesz szó.